Πώς να βρείτε τον αριθμό των πρωτονίων, ηλεκτρονίων και νετρονίων
Συγγραφέας:
Roger Morrison
Ημερομηνία Δημιουργίας:
27 Σεπτέμβριος 2021
Ημερομηνία Ενημέρωσης:
1 Ιούλιος 2024

Περιεχόμενο
- στάδια
- Μέρος 1 Υπολογίστε τον αριθμό των πρωτονίων, των ηλεκτρονίων και των νετρονίων
- Μέρος 2 Υπολογίστε τον αριθμό των ηλεκτρονίων σε ένα ιόν
Τα νετρόνια, τα ηλεκτρόνια και τα πρωτόνια είναι τα τρία κύρια σωματίδια που συνθέτουν ένα άτομο. Όπως μπορείτε να μαντέψετε, τα πρωτόνια έχουν ένα θετικό φορτίο, τα ηλεκτρόνια φέρουν ένα αρνητικό φορτίο, και τα νετρόνια είναι ακριβώς ουδέτερα σωματίδια. Η μάζα των ηλεκτρονίων είναι πολύ μικρή. Ωστόσο, τα νετρόνια και τα πρωτόνια έχουν παρόμοιες μάζες. Για να βρούμε τον αριθμό των πρωτονίων, των ηλεκτρονίων και των νετρονίων ενός ατόμου, αρκεί να συμβουλευτούμε τον περιοδικό πίνακα των στοιχείων, που ονομάζεται επίσης πίνακας του Mendeleev.
στάδια
Μέρος 1 Υπολογίστε τον αριθμό των πρωτονίων, των ηλεκτρονίων και των νετρονίων
-
Λάβετε έναν περιοδικό πίνακα στοιχείων. Αυτός ο πίνακας θα σας βοηθήσει να βρείτε τον αριθμό των πρωτονίων, των ηλεκτρονίων και των νετρονίων σε ένα στοιχείο. Είναι ένας πίνακας που παρουσιάζει τα στοιχεία σύμφωνα με την ατομική τους δομή. Ένας χρωματικός κώδικας διακρίνει τα διάφορα στοιχεία. Κάθε στοιχείο αναγνωρίζεται από ένα σύμβολο που αποτελείται από ένα, δύο ή τρία γράμματα. Ο πίνακας δείχνει επίσης άλλες πληροφορίες, όπως η ατομική μάζα και ο ατομικός αριθμός κάθε στοιχείου.- Μπορείτε να βρείτε αυτό το γράφημα είτε κάνοντας μια αναζήτηση στο διαδίκτυο ή σε ένα βιβλίο χημείας.
- Στις εξετάσεις, κανονικά θα επιτρέπεται να χρησιμοποιείτε έναν περιοδικό πίνακα στοιχείων.
-
Προσδιορίστε το στοιχείο σας στον περιοδικό πίνακα. Στον πίνακα, τα στοιχεία ομαδοποιούνται σύμφωνα με τον ατομικό τους αριθμό. Διακρίνονται σε τρεις κύριες κατηγορίες: μέταλλα, μη μέταλλα και μεταλλοειδή (ημι-μέταλλα). Άλλες ομάδες περιλαμβάνουν αλκαλικά μέταλλα, αλογόνα και ευγενή αέρια.- Είναι ευκολότερο να εντοπίσετε ένα στοιχείο στη συστοιχία χρησιμοποιώντας την ομάδα (στήλη) ή την περίοδο (σειρά).
- Αν δεν γνωρίζετε τις ιδιότητες του στοιχείου, μπορείτε να αναζητήσετε το σύμβολο του.
-
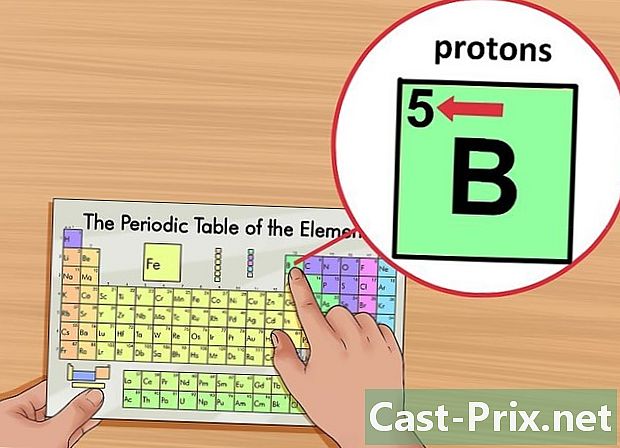
Εντοπίστε τον ατομικό αριθμό του στοιχείου. Αυτός ο αριθμός σημειώνεται στην επάνω αριστερή γωνία του πλαισίου, πάνω από το σύμβολο του στοιχείου. Ο ατομικός αριθμός σας δίνει τον αριθμό των πρωτονίων που αποτελούν το εν λόγω στοιχείο.- Για παράδειγμα, ο ατομικός αριθμός του βορίου (Β) είναι 5. Έτσι, έχει 5 πρωτόνια.
-

Προσδιορίστε τον αριθμό των ηλεκτρονίων. Ο πυρήνας ενός ατόμου περιλαμβάνει πρωτόνια που είναι θετικά φορτισμένα σωματίδια. Τα ηλεκτρόνια είναι αρνητικά φορτισμένα σωματίδια. Επομένως, ο αριθμός των πρωτονίων και των ηλεκτρονίων ενός ουδέτερου στοιχείου θα είναι ο ίδιος.- Για παράδειγμα, το βόριο (Β) έχει ατομικό αριθμό 5, οπότε έχει 5 πρωτόνια και 5 ηλεκτρόνια.
- Ωστόσο, αν είναι ένα θετικό ή αρνητικό ιόν, ο αριθμός των πρωτονίων και ο αριθμός των ηλεκτρονίων θα είναι διαφορετικός. Θα πρέπει να τα υπολογίσετε. Η χρέωση του λιονταριού υποδεικνύεται σε μικρή εκτύπωση από έναν εκθέτη μετά το αντίστοιχο στοιχείο.
-

Αναζητήστε την ατομική μάζα του στοιχείου. Αυτό το βήμα θα σας επιτρέψει να βρείτε τον αριθμό των νετρονίων. Θα πρέπει πρώτα να προσδιορίσετε την ατομική μάζα ή το ατομικό βάρος του στοιχείου. Αυτό το δεδομένο αντιπροσωπεύει τη μέση μάζα των ατόμων αυτού του στοιχείου. Είναι εγγεγραμμένο κάτω από το σύμβολο του στοιχείου.- Φροντίστε να γυρίσετε την ατομική μάζα του στοιχείου στον πλησιέστερο ακέραιο αριθμό. Έτσι, το βόριο έχει μια ατομική μάζα 10.811, αλλά θα πρέπει να κυλήσετε στο 11.
-

Κάντε τη διαφορά μεταξύ του ατομικού αριθμού και της ατομικής μάζας. Για να υπολογίσετε τον αριθμό των νετρονίων, πρέπει να διαφοροποιήσετε τον ατομικό αριθμό από την ατομική μάζα. Μην ξεχνάτε ότι γνωρίζετε ήδη τον ατομικό αριθμό. Είναι απλά όμοιο με αυτό των πρωτονίων.- Για το βόριο, θα έχετε: 11 (ατομική μάζα) - 5 (ατομικός αριθμός) = 6 νετρόνια
Μέρος 2 Υπολογίστε τον αριθμό των ηλεκτρονίων σε ένα ιόν
-

Βρείτε το ηλεκτρικό φορτίο ενός ιόντος. Αυτός ο αριθμός εμφανίζεται από τον εκθέτη μετά το σύμβολο στοιχείου. Ένα ιόν είναι ένα άτομο με θετικό ή αρνητικό φορτίο λόγω της προσθήκης ή της καταστολής των ηλεκτρονίων. Ο αριθμός των πρωτονίων σε ένα άτομο δεν ποικίλλει. Ωστόσο, σε ένα ιόν, ο αριθμός των ηλεκτρονίων μεταβάλλεται.- Δεδομένου ότι ένα ηλεκτρόνιο έχει αρνητικό φορτίο, γίνεται θετικό μετά την αφαίρεση ενός ή περισσοτέρων ηλεκτρονίων. Από την άλλη πλευρά, η προσθήκη ηλεκτρονίων θα έχει ως αποτέλεσμα να καθιστά το φορτίο αρνητικό.
- Για παράδειγμα, το φορτίο του Ν είναι -3. Από την άλλη πλευρά, αυτή του Ca είναι +2.
- Μην ξεχνάτε ότι αυτός ο υπολογισμός δεν είναι απαραίτητος, εάν το σύμβολο του στοιχείου δεν ακολουθείται από έναν εκθέτη.
-

Αφαιρέστε τη φόρτιση από τον ατομικό αριθμό. Αρχικά, ένα ιόν με θετικό φορτίο είναι ένα άτομο που έχει χάσει ηλεκτρόνια. Για να βρείτε τον αριθμό των ηλεκτρονίων, πρέπει να αφαιρέσετε τις πρόσθετες χρεώσεις από τον ατομικό αριθμό. Αν το λιοντάρι είναι θετικό, ο αριθμός των πρωτονίων είναι μεγαλύτερος από τον αριθμό των ηλεκτρονίων.- Για παράδειγμα, το φορτίο του Ca είναι +2. Ως αποτέλεσμα, έχασε 2 ηλεκτρόνια σε σύγκριση με την αρχική του κατάσταση. Ο ατομικός αριθμός του ασβεστίου είναι ίσος με 20, έτσι το λιοντάρι έχει 18 ηλεκτρόνια.
-

Προσθέστε μια επιβάρυνση στον ατομικό αριθμό αρνητικών ιόντων. Όταν ένα ιόν είναι αρνητικά φορτισμένο, το latome έχει επιπλέον ηλεκτρόνια. Για να υπολογιστεί ο συνολικός αριθμός ηλεκτρονίων αρκεί να προσθέσουμε τον αριθμό των πρόσθετων χρεώσεων στον ατομικό αριθμό. Αν το λιοντάρι είναι αρνητικό, έχει λιγότερα πρωτόνια από το ηλεκτρόνιο.- Για παράδειγμα, το φορτίο του Ν είναι -3. Έτσι, μεταφέρει 3 ηλεκτρόνια σε σύγκριση με την αρχική κατάσταση. Ο ατομικός αριθμός του λαζωτού είναι 7. Επομένως, αυτό το ιόν έχει 10 ηλεκτρόνια.